Kategóriák
- Vizsgálati kisokos (5)
- Egyéb kategória (17)
- Hírek (100)
- Betegségek (52)
Relyvrio az ALS kezelésében, nagy ígéretek, be nem váltott remények
Az USA-ban Relyvrio néven forgalomba hozott, nátrium-fenilbutirát és taurursodiol hatóanyagokat tartalmazó kombinációs készítményt 2022 szeptemberében engedélyezte az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (Food and Drug Administration, röviden FDA) felnőttkorú ALS-sal élő betegek számára.
A gyógyszert porként formulálták, egy tasak 3 g nátrium-fenilbutirátot és 1 g taurursodiolt tartalmaz. A készítményt egy pohárnyi vízben kell feloldani, majd szájon át vagy gasztrosztómába adagolva lehet elfogyasztani. Nem pontosan ismert a Relyvrio hatásmechanizmusa, vélhetően az energiatermelő sejtszervecskék, a mitokondriumok és a fehérjék érlelését végző sejtalkotó, az endoplazmás retikulum működését befolyásolja, és a sejten belüli stressz szintjét csökkentve éri el a mozgató idegsejtek pusztulásának mérséklését.

A gyógyszervizsgálatok során a leggyakrabban tapasztalt mellékhatások közé tartozott a hasmenés, a hányinger, illetve a hasi fájdalom. Észlelték továbbá a keringő epesavak szintjének megemelkedését, ami súlyosbította az esetleges hasmenést, ezért csökkent mértékben szívódhatott fel a hatóanyag. Összességében a gyógyszervizsgálatban résztvevő betegek 12%-a tapasztalt a szer használata során mellékhatásokat.
A CENTAUR gyógyszervizsgálatban résztvevő 137 beteg közül 89-en részesültek Relyvrio terápiában, átlagosan a kísérleti szert kapó betegek ALS-e 25%-kal lassabban haladt előre mint a placebot kapó betegek társaiké. A 24 hétből álló első fázis után a betegek több mint 90 százaléka vett részt a kiterjesztett fázisú gyógyszervizsgálatban. A hosszú távú követéses adatok azt mutatják, hogy a Relyvrio terápiában részesülő betegek majdnem hét hónappal tovább éltek, mint a placebo kezelésben részesülő betegtársaik.
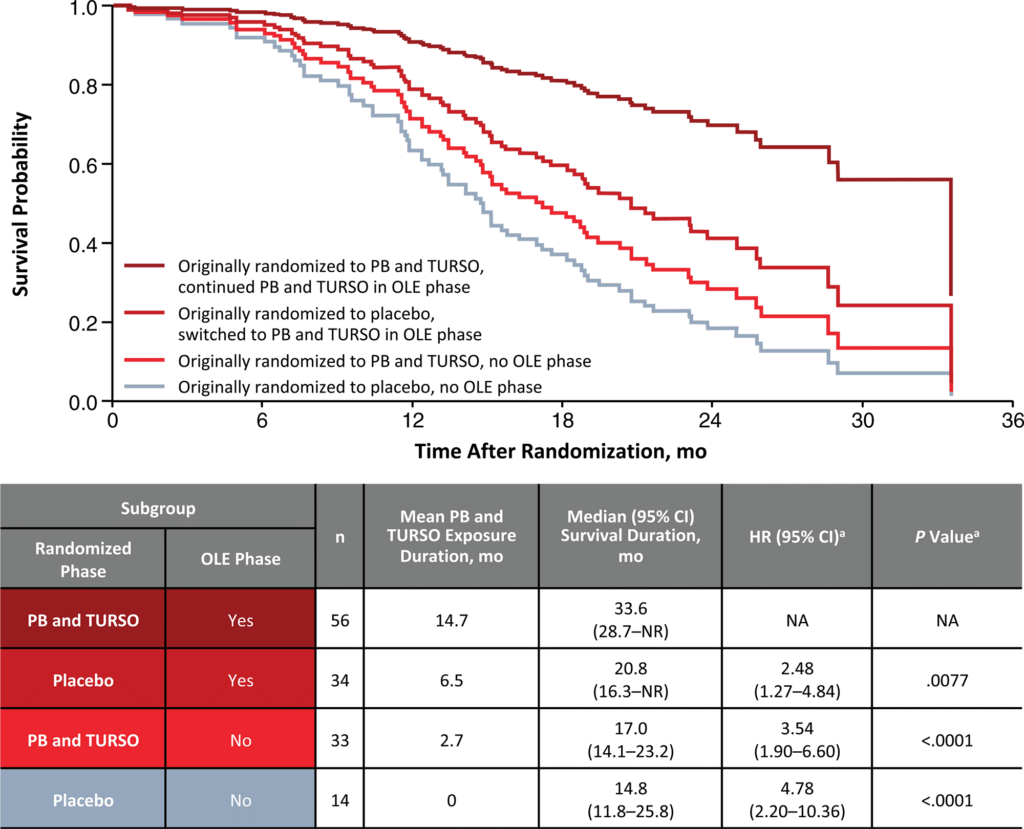
Egy következő, a PHOENIX gyógyszervizsgálat során 48 héten keresztül hasonlítottak össze a Relyvriot illetve a placebot kapó ALS betegek adatait. Sajnos, a PHOENIX vizsgálat adatai nem tudták igazolni, hogy a kísérleti szer lassítaná a betegség lefolyását. Így visszavonták a gyógyszer forgalomba hozatali engedélyét mind az USA-ban, mind Kanadában. Azonban nem állították le a további ALS betegeken végzett kísérleteket ezzel a szerrel, még további két évig gyűjtenek túlélési adatokat a kísérleti szert szedő betegekről . A gyártócég jelenleg azon dolgozik, hogy más neurodegeneratív betegségekben bizonyítsa a hatóanyagkombináció hatásosságát, mint például a progresszív szupranukleáris bénulásban (PSP) vagy a Wolfram szindrómában.
Források:
https://alsnewstoday.com/amx0035/
https://alsnewstoday.com/news/relyvrio-withdrawn-from-us-canada-after-phase-3-trial-results/
https://alsnewstoday.com/news/aan-2024-als-trial-investigator-shares-details-relyvrio-failure/
https://alsnewstoday.com/news/als-treatment-relyvrio-fails-trial-may-be-withdrawn-market/
https://clinicaltrials.gov/study/NCT03488524
https://clinicaltrials.gov/study/NCT05021536
https://biopharma.media/amyotrophic-lateral-sclerosis-new-drug-on-horizon-2153/
Szerkesztette: dr. Nagy Zsófia Flóra
2024. június 24.