Kategóriák
- Vizsgálati kisokos (5)
- Egyéb kategória (17)
- Hírek (100)
- Betegségek (52)
Tofersen: új, genetikai alapú terápia amiotrófiás laterálszklerózissal diagnosztizált betegek részére
2024.02.22-én fogadta be az Európai Gyógyszerügynökség Emberi Felhasználásra Szánt Gyógyszerkészítmények Bizottsága (Committee for Medicinal Products for Human Use) a tofersen hatóanyagot tartalmazó, Qalsody néven forgalomba hozott gyógyszert. Az új gyógyszer törzskönyvezésével már kettő amiotrófiás laterálszklerózis indikációban elérhető terápia áll rendelkezésére az európai ALS betegeknek.
A tofersen a SOD1 (szuperoxid dizmutáz 1) gén mutációit hordozó felnőttkorú betegek számára lett kifejlesztve, és azáltal hat, hogy a génről leíródó fehérje mennyiségét csökkenti. Európai származású betegek esetében a családi halmozódású ALS esetek akár 14%-ában is kimutatható a SOD1 gén érintettsége, míg a sporadikus esetek 1%-ában (nincs családi halmozódása a betegségnek) azonosítható egy SOD1 mutáció. További, részletes információ a SOD1 gén és az ALS kapcsolatáról egy korábbi cikkünkben olvasható: https://izominfo.rirosz.hu/az-amiotrofias-lateralszklerozis-als-genetikai-hattere/.
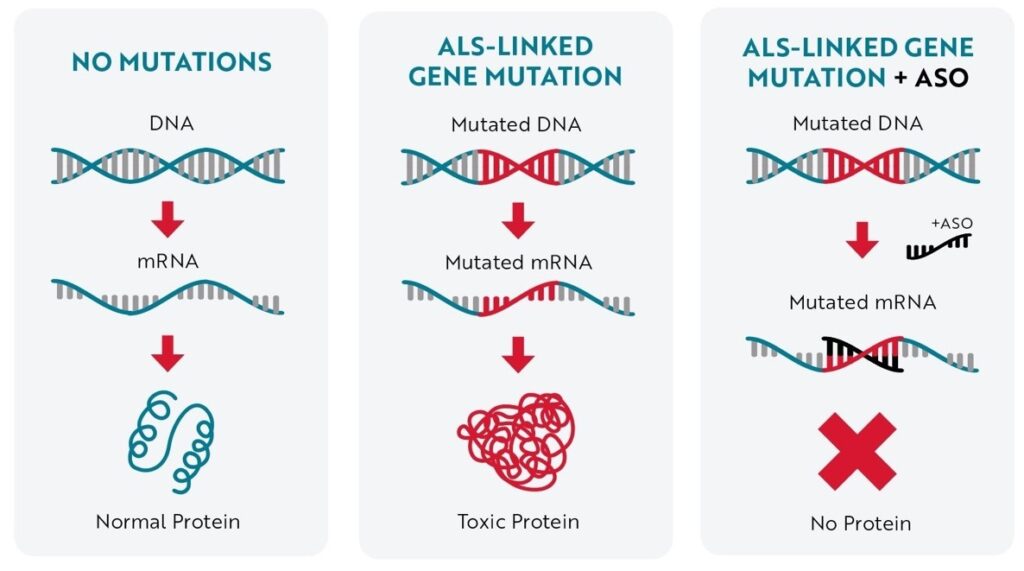
Elsőként a gyógyszerkísérletbe 108 SOD1 mutációt hordozó ALS beteg került bevonásra. A legfiatalabb beteg 23 éves, a legidősebb 78 éves volt a gyógyszervizsgálat kezdetekor. 28 héten keresztül kapott a bevont betegek 2/3-a gyógyszert, míg a betegek 1/3-a placebo karra került, a 28 hetes periódusban nem kaptak kísérleti gyógyszert. Később a nyílt vizsgálati szakaszban minden bevont beteg részesült a Qalsody kezelésben.
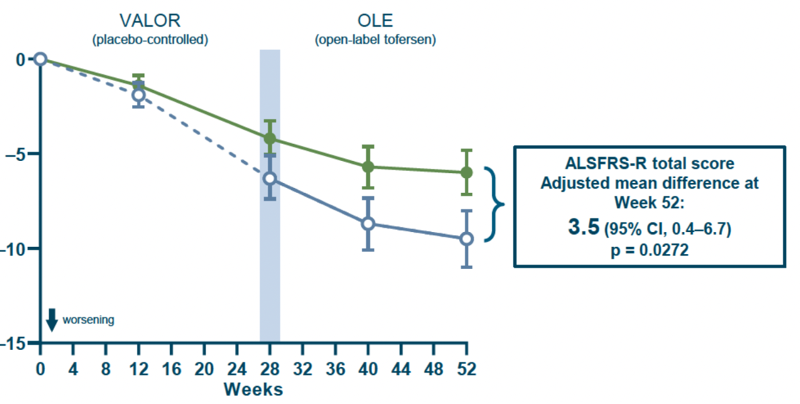
A 28 hetes vak elrendezésű szakaszban mérték a betegség előrehaladásának sebességét és a betegek életminőségét az ALS funkcionális pontozóskála (ALS FRS-R) segítségével, biomarkerek változását, valamint mérték a légzésfunkciós paraméterek változását és a kezek szorítóerejét. A 28 hetes periódus végén nem láttak még szignifikáns eredményeket, így további 12 hónapig folytatták a vizsgálatot. A kiegészítő, nyílt vizsgálati szakasz végére meg tudták állapítani, hogy a Qalsody lassítja a betegség klinikai lefolyását, csökkenti a SOD1 protein szintjét a gerincvelői folyadékban, stabilan tartja a légzésfunkciós paramétereket és a beteg életminőségét.
A gyógyszert gerincvelői folyadékba kell beadni lumbálpunkció útján. Az első 3 feltöltő injekciót 14 naponta kapják a betegek, majd a további dózisokat 28 napos időközönként kell beadni. A gyógyszer leggyakoribb mellékhatásai kapcsolódnak a lumbálpunkcióhoz, a gyógyszerkísérletben részt vevő betegek körében a leggyakoribb mellékhatás a szúrás helyén érzett fájdalom, izomfájdalom, ízületi fájdalom voltak. Pár esetben számoltak be lázról, vagy fehérvérsejt felszaporodásról a gerincvelői folyadékban.
Jelenleg még nincs adat arra, hogy az ismerten SOD1 mutációt hordozó, de aktuálisan tünetmentes (úgynevezett preszimptómás) egyénekben a tofersen késleltetni tudja-e vagy akár teljesen megakadályozza a betegség kialakulását. Erre vonatkozóan további kísérleteket terveznek a jövőben.
Magyarországon is vannak már betegek akik a korai hozzáférési program keretein belül részesülnek a Qalsody gyógyszerben.
Forrás:
- https://www.ema.europa.eu/en/medicines/human/EPAR/qalsody
- https://izominfo.rirosz.hu/az-amiotrofias-lateralszklerozis-als-genetikai-hattere/
- https://www.als.org/navigating-als/living-with-als/fda-approved-drugs/tofersen
- https://www.nejm.org/doi/full/10.1056/NEJMoa2204705
- https://jnnp.bmj.com/content/93/9/e2.208
- https://investors.biogen.com/news-releases/news-release-details/new-england-journal-medicine-publishes-pivotal-tofersen-data
- https://www.cureffi.org/2021/10/18/middling-results-tofersen-sod1-als/
Szerkesztette: Dr. Nagy Zsófia Flóra
2024. április 03.